快讯
医美行业观察

众山生物研发总监王朋田:以高质量高标准引领医药级透明质酸钠无菌时代
随着医美行业的高速发展,市场对产品质量的要求不断提高,与此同时,决定产品质量的上游厂商的综合实力越来越受到关注。尤其是在监管力度逐渐加大的趋势下,高质量、高标准的原料成为产品是否合规、是否受到市场认可的关键因素。
近日,在医美行业观察主办的「轻医美 见未来·2023中国轻医美大会」上,众山生物研发总监王朋田以《医药级透明质酸钠关键质量指标浅谈及无菌趋势思考》为主题带来干货分享,以下为精彩内容:

各位好,我叫王朋田,来自山东众山生物科技有限公司。
众山生物专注于玻尿酸的生产研发多年,在药用原料和医疗器械用原料上都有布局,今天我主要关注和表达的是医疗器械方面。
下图是众山医药级产品的列表
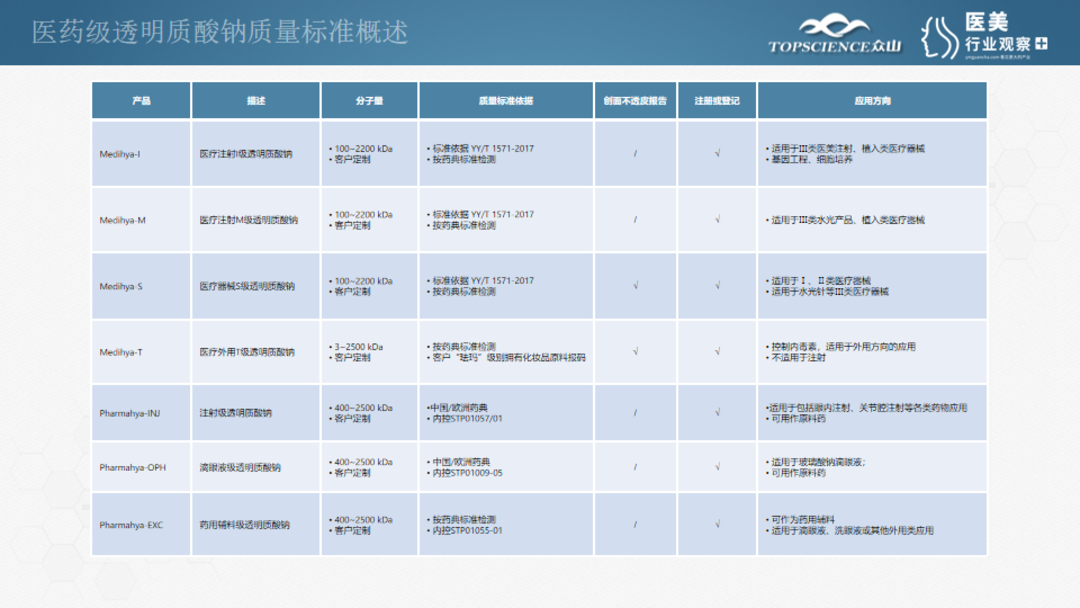
关于医疗器械原料的部分,可以看到:我们拥有医疗外用T级产品、医疗器械S级产品、医疗注射M级和I级产品,4个规格的产品都可以做到分子量10万Dal到220万Dal的定制化生产;质量标准主要依据《YYT 1571-2017 组织工程医疗器械产品 透明质酸钠》行业标准设定,检测方法整合了各个国家和地区的细节要求;根据应用需求,部分规格的产品完成了创面不透皮收实验;生产工艺也完成了国家药监局医疗器械司的主文档登记工作。值得一提的是:众山的药用级产品,分别完成了中国NMPA、欧盟CEP、FDA、KFDA、印度form41等国家和地区的官方注册,更能从侧面反应众山产品的高品质。
4类指标反应原料供应技术水平
下面,我们汇总了医药级透明质酸钠产品尽可能全面的检测项目,并根据检测指标的内容,将他们分为四个大类。
第一类:性质指标,包括外观 、鉴别、HA含量、pH、干燥失重等指标,这些指标反映产品最基本的情况。对于一个优良的原料供应商来说,做好这些指标内容是最基本的要求。
第二类:杂质以及安全指标,包括核酸、蛋白等生物残留类杂质,包括重金属、氯化物、乙醇残留、溶血性实验等指标,特别是内毒素指标。这些指标真正反映了原料供应商的生产技术水平。
其中“内毒素”是非常关键的安全指标之一。因为在生产过程中不易去除,细菌内毒素指标成为生产高品质医药级透明质酸钠的技术壁垒之一。
目前国内对于内毒素水平要求控制在<0.05 IU/mg,众山生物内毒素实测值可以做到≤0.001 EU/mg,是欧洲药典国际标准值的1/50。
第三类:黏度性质指标。黏度也叫粘度,是对液体受外力作用移动时,分子间产生内摩擦力的度量。内摩擦力越大,黏度越大。
目前常见的黏度定义有动力粘度、运动粘度、特性粘度。其中以特性粘度应用最为普遍。但是,对特性粘度的检测,又根据不同法规或行业标准,分为EP法、JP法、1571法。
随着科技的发展,众山使用HPLC联用视差检测器、小角度激光散射器等先进方法,精准测定透明质酸钠的重均分子量、数均分子量等信息,并获得分子量分布的情况。其中,重均分子量也是国内透明质酸钠医疗器械原料重要的分子量检测项目。透明质酸钠作为一个大分子聚合物,分子量分布的情况能从一定程度上反应产品质量。
众山依靠多年的生产、技术支持经验,可以为客户精准定制特性粘度或者分子量在预期范围的目标产品。
第四类,微生物指标。根据微生物指标情况,市面上产品分为三种,一个就是限度检测合格的产品,即:含有微生物但是数值在限度范围之内;第二是检测无菌的产品,即:检测不出来微生物,但是制备工艺不能达到无菌要求;第三就是众山生物刚刚推出的,工艺无菌透明质酸钠产品。微生物的指标表达起来看似简单,但是在实际生产过程中控制起来非常有难度,并且目前终端医疗器械常用的湿热灭菌方式,主要针对微生物指标,不排除在此过程有其他反应产生。
微生物指标是提升质量的关键
通过上面的表述,我们可以了解到,基本性质指标是对原料的基本要求,已被做到极致;杂质及安全指标,能够真正反映生产企业的技术水平;粘度性质指标,能够反应生产企业的定制化生产能力。但是,如果微生物指标做的不够到位,是可以反过来影响这些已经做的很好的指标内容的。
从微生物限度进行思考。
如果产品仅仅是微生物限度检测合格,不排除我们的粉末里面有微生物的活体的残留,那么在后续储存、生产、使用过程中,微生物就有可能繁殖放大,进而影响产品质量。哪怕是检测无菌的产品,也仅代表通过微生物的限度检查,没有检测出微生物,并不是100%从工艺整个过程中保证排除微生物的过程,仍然为后续微生物的出现提供了可能。
再从湿热灭菌角度进行思考,有三个方面的影响。
第一,是分子量的上限。假如我们做医疗器械过程中有湿热灭菌的环节存在,我们无法将灭菌前的最大分子量带到终端产品中。举个例子,假如我们购买的是200万分子量的产品,经过湿热灭菌可能就变成150万分子量的产品,而我们又知道,分子量大小对终端产品的性能起到非常大的决定作用。
第二,是杂质的变化。假如我们的产品微生物限度检测合格,但是还有一点微生物存在,经过湿热灭菌,微生物被杀灭,菌体片断不排除会带来新的内毒素,以及其它杂质的产生。当然,因为湿热灭菌温度和时间的问题,我们也不排除配方后的制剂,在湿热灭菌过程中发生其他的副反应。
第三,是HA小片断。由于HA是一种直链大分子聚合物,我们所表述的分子量是一种平均分子量,任何分子量结果的HA产品,都含有一部分比较小的分子片段。这些小分子片段,经过湿热灭菌之后,会变得更小。然而,有一些研究报道,这些极小的片段,有可能引起不良反应。

从湿热灭菌这个角度,做一些工艺上的无菌产品,更能够符合市场的预期。
多环节把控引领原料高质量高标准
经过以上的分析,容易看出医药级透明质酸钠质量的关键点以及发展趋势,即无菌控制。基于10多年的经验积累,我们开发出了一套无菌生产工艺。从起始物料开始,经过溶解、吸附、一次过滤、二次过滤、冗余除菌过滤、结晶洗涤、脱水干燥等流程,获得工艺无菌的产品。
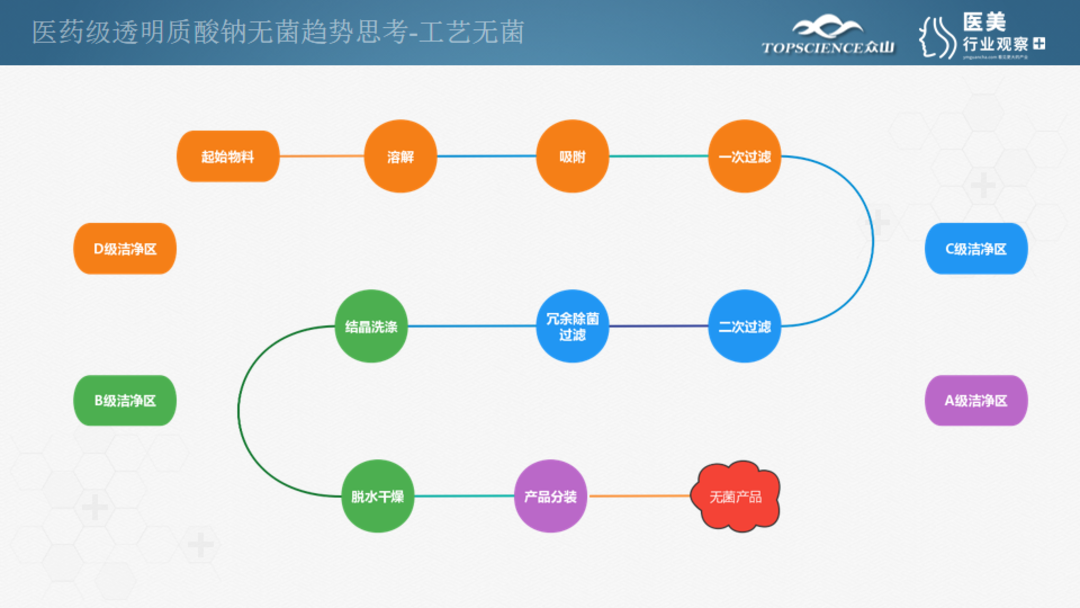
上面是一个简单的工艺流程图,为了保证无菌的要求实际上有诸多注意的点。
人员方面,除了基本的专业素养,还需要专门的技能培训、资格确认、行为规范管理与特殊的健康管理等等要求。
设备方面,除了DQ/IQ/OQ/PQ的要求,还有CIP/SIP在线清洁和在线灭菌规程。当然,完备的、符合使用要求的空调系统、注射用水系统和气体系统也必不可少。
物料管理方面,我们对物料管理遵从原料药的管理规定,取样检验、物料传递方面都有专门的管理与操作流程。
质量管理与厂房设施方面,在完善的质量管理体系之下,从原料到过程到最后产品,保证整个过程在密闭的生产系统中处理,结合从D级到C级到B加A级的洁净环境,生产过程管控要求极为严格。
无菌医药级透明质酸钠优点的总结
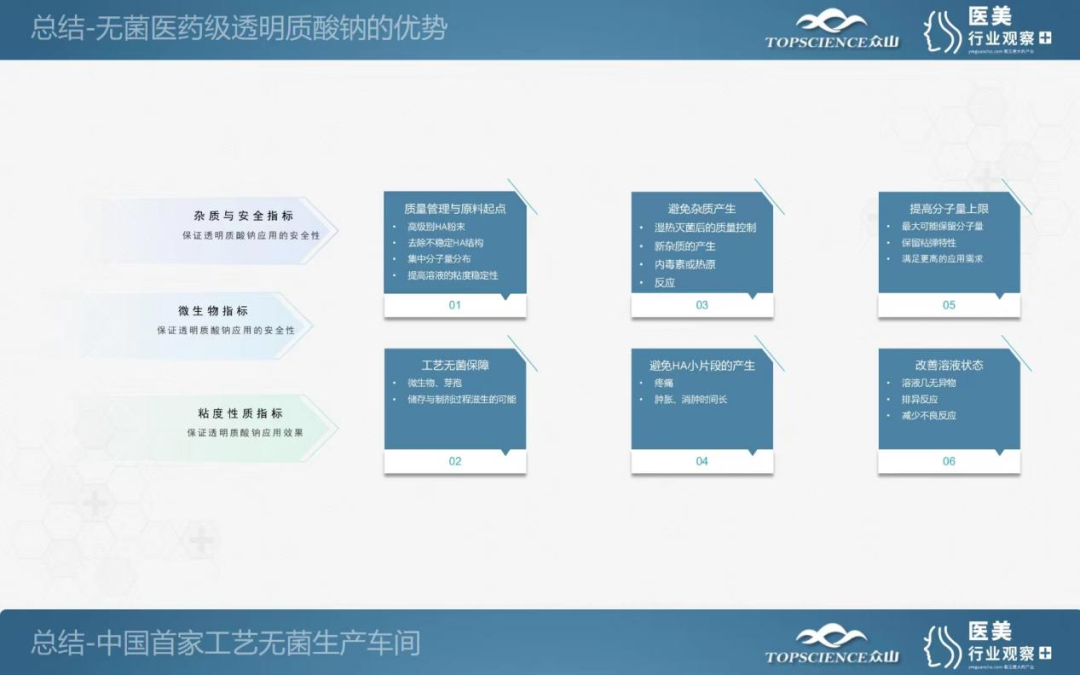
所以,思考的最后就是:为了能够赋能医疗级透明质酸钠市场,满足更高的市场需求,众山生物推出了中国首家无菌透明质酸钠车间,欢迎各位老师到我们工厂里面去看我们的实际的生产线,对我们进行指导,我们做进一步的沟通和交流,感谢!

文章来源:医美行业观察
版权声明:转载医美医美行业观察的原创文章,需注明文章来源以及作者名称。公众号转载请联系开白小助手(微信号:pingshalaile)。违规转载法律必究。

扫描二维码,第一时间获取医美行业的资讯和动态。
从此和医美医美行业观察建立直接联系。
本栏目文字内容归ymguancha.com所有,任何单位及个人未经许可,不得擅自转载使用。
Copyright © 医美行业观察 | 京ICP备20027311号-1
参与评论