快讯
医美行业观察

华东医药合作肉毒素ATGC-110在韩上市获受理,海外市场也将放量?
2月19日,华东医药战略合作伙伴韩国ATGC对外宣布,其含有A型肉毒杆菌毒素的产品ATGC-110的上市申请已获韩国食品药品安全部(MFDS)受理。
对此,华东医药表示,此次ATGC-110韩国上市申请获得受理,是其注册研发的重要里程碑之一,目前该公司正在积极推进ATGC-110在全球其他各区域的临床及注册申报工作。
此次申请上市的韩国是医美消费大国,肉毒素更是韩国医美市场较为火爆的项目。
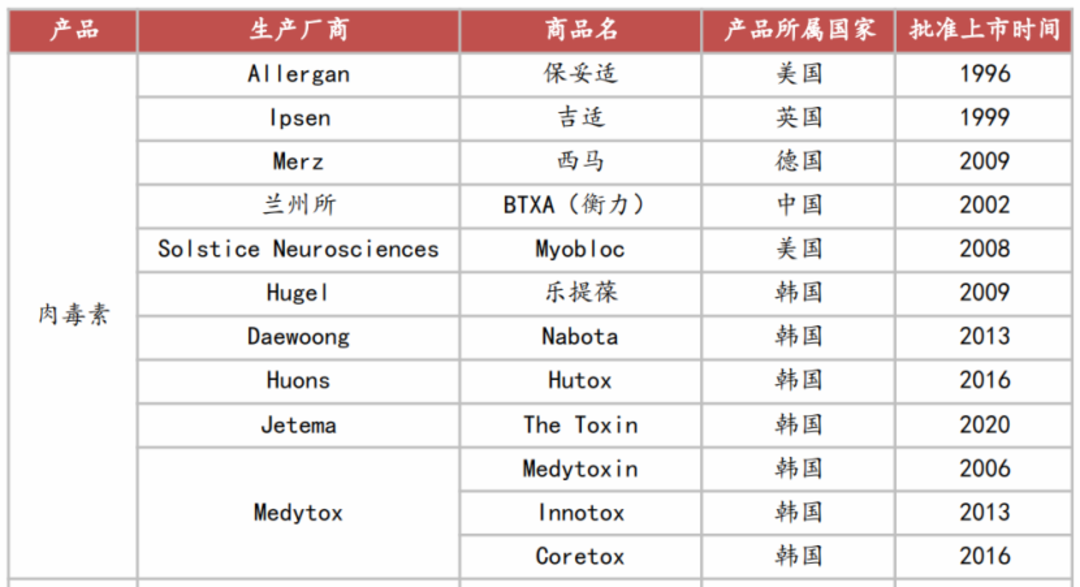
(图片内容为韩国部分获批上市的肉毒素产品,来源为西南证券)
就目前韩国肉毒素市场来看,由于审批制度的宽松,进口和本土产品都比较多,但也正因如此,韩国肉毒素市场集中度低,且市场格局分散,整体还处于竞争激烈阶段。因此对于华东医药来说,此次若是旗下ATGC-110成功获批,除了需要通过差异化的优势打开市场,后期的产能也得及时跟上。
除了海外市场,华东医药肉毒素在国内也得尽快上市,目前国内肉毒素市场也极具特点。
目前的国内获批肉毒素只有四个,分别为衡力、保妥适、乐提葆、吉适,其中仅衡力为国产肉毒素产品。
虽然国内肉毒素的获批数十分少,但是候选者却很多,但是多数为外部引进。公开资料显示,目前爱美客、复星医药、昊海生科、步长制药、LG化学、康哲药业、因明生物等均在研或代理了肉毒素产品,其中爱美客的Hutox(橙毒)、复星医药的RTO02、精鼎医药的Xeomin(德国西马)等产品有望在2024年获批。
以上来看,目前国内肉毒素市场渗透率并不高,且亟需国产替代,且因为国产替代存在研发难关,目前国内外玩家多选择通过外部引进产品实现产业渗透。
因此肉毒素产品上市的先后顺序对于玩家十分重要。
围观肉毒素的研发流程,大体包括临床试验前准备、临床试验、申报注册、审评审批、条件批准和上市几个步骤,其中临床试验阶段包括I期、II期和III期三个阶段。整体时间为8-10年左右,而对于省略研发阶段,从外部引入产品,直接跨步到审批阶段的肉毒素产品来说,成功上市大约得5年时间,耗时较长。
回看华东医药,2023年华东医药曾先后两次布局肉毒素产品。
其一,2023年10月,华东医药获得ATGC-110在中国、美国、欧洲等区域在内的全球独家许可(不含印度),以及在韩国的非独家许可,包含医美及治疗的所有适应症的临床开发、注册及商业化权益。
其二,2023年11月,华东医药引进重庆誉颜制药有限公司的重组A型肉毒素在研产品YY001,获得该产品在中国大陆、香港特别行政区、澳门特别行政区医美适应症领域的独家商业化权益。
对于华东医药布局的两个肉毒素产品来说,除了ATGC-110正在谋求在韩上市,YY001则正在筹备Ⅲ期临床,YY001有望早于ATGC-110于中国市场上市。
如此来看,华东医药虽然已经布局了两个肉毒素产品,但是都在走流程,肉毒素产品放量仍然需要时间。
关于后续华东医药肉毒素产品的进展情况,医美行业观察将会持续关注!
文章来源:医美行业观察
版权声明:转载医美医美行业观察的原创文章,需注明文章来源以及作者名称。公众号转载请联系开白小助手(微信号:pingshalaile)。违规转载法律必究。

扫描二维码,第一时间获取医美行业的资讯和动态。
从此和医美医美行业观察建立直接联系。
本栏目文字内容归ymguancha.com所有,任何单位及个人未经许可,不得擅自转载使用。
Copyright © 医美行业观察 | 京ICP备20027311号-1
参与评论